Алотропні модифікації неметалів

Природа ніколи не перестає дивувати тих, хто намагається розгадати її таємниці.
Сьогодні розглянемо одне з природних явищ, яке має назву "алотропія". Ми знаємо, що всі речовини утворені з дрібних частинок — атомів. На сьогодні вченими відкрито 118 видів атомів (хімічних елементів). Перекомбінації атомів дають величезну кількість як простих (більше 400), так і складних речовин. "І що ж тут нового?", - запитаєте ви. Думаю, цікаво дізнатися про те, що існують такі хімічні елементи (атоми), що утворюють декілька різних простих речовин — алотропів (алотропних модифікацій).
Як приклад пригадаємо, що кисень, яким дихають майже всі живі істоти утворюється двома атомами Оксигену і має хімічну формулу О2, а газ озон, який захищає Землю від жорсткого ультрафіолетового випромінювання, теж утворюється з атомів Оксигену і має формулу О3.
Отже кисень та озон є алотропними модифікаціями одного хімічного елемента Оксигену.
Явище алотропії відоме для невеликої кількості хімічних елементів-неметалів, а також деяких металів. Алотропи можуть відрізнятися між собою фізичними і хімічними властивостями, поширеністю в природі та способами добування і використання. А також модифікації за певних умов можуть одна в одну перетворюватися.
Так озон, на відміну від кисню, має запах, отруйний, має вищі температуру кипіння та плавлення і є більш хімічно активним. У невеликих кількостях він є чудовим антисептиком і використовується для знезаражування води та приміщень лікарень. У суміші з киснем використовується як окисник для ракетного палива. Утворюється з кисню за умови високої температури (розряд блискавки). Відчути його запах можна після грози. Реакція утворення озону з кисню є оборотною. О2 + О ↔ О3
Найкраще вивчено явище алотропії для таких хімічних елементів як Карбон, Оксиген, Фосфор, Сульфур, Селен.
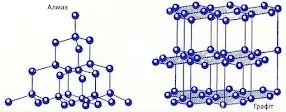
Для Карбону відомі такі алотропи як алмаз, лонсдейліт, графіт, аморфний вуглець, фулерени, нанотрубки, карбін, графен. Частина з них природні, а частина — добуті штучно. За відкриття графену (2004 рік) в 2010 році фізики Манчестерського університету Гейм та Новосьолов отримали Нобелівську премію. Графен одношарова модифікація Карбону товщиною в атом, найтонший, найлегший і найміцніший матеріал (у 200 разів за сталь), витримує навантаження у 5 т і більше без руйнування. Розкладається бактеріями тому є екологічно безпечним.
Лонсдейліт знаходять у кратерах астероїдів. Його добувають з графіту з використанням величезного тиску. Можна його добути і з алмазу. Лонсдейліт дуже схожий до алмазу але менш твердий, має коричнево-жовтий колір і алмазний блиск. Його відносять до металоїдів. Валентні кути кристалічних граток алмазу та лонсдейліту однакові та становлять 109°28’16’’ , але координаційне число в гратці алмазу — 8, а в лонсдейліту — 4.
Практичне використання цього алотропу сумнівне через складність його добування.
Найширше використовуються алмаз та графіт. Алмаз є природним коштовним мінералом. Прикраси з нього мають високу ціну. За шкалою твердості Мооса він є самим твердим серед мінералів.
Графіт теж природна речовина, але навпаки є м'якою, непрозорою, сіро-чорного кольору та електропровідною. Графітові стержні використовуються як електроди або як олівці. Такі відмінності між алмазом, графітом та іншими алотропними модифікаціями Карбону обумовлені особливостями будови кристалічних граток цих речовин.

У сучасних нанотехнологіях все частіше застосовуються й інші алотропні видозміни Карбону, зокрема використання нанотрубок здійснило революцію в генетичній медицині та фармакології. Вони можуть використовуватися для ранньої діагностики раку та хвороб, що викликані збоями в роботі ДНК. Нанотрубки створені штучно в 1991 році. Вони мають довжину 100 нм, а діаметр — 1-2 нм. Ускладнюється активність їх використання в медицині тим, що нанотрубки не розчиняються у фізіологічних рідинах. Вчені шукають шляхи подолання цієї проблеми.
Фулерени — тверді кристалічні речовини, алотропи Карбону сферичної форми. Створені у 1990 році. Їх молекули можуть містити по 20, 24, 28.....60, 70, 200 атомів Карбону. Найстійкішою є модифікація С60.



Це сильний антиоксидант, що має надпровідні властивості. Дуже дорогий матеріал але перспективи його використання широкі.
Фосфор в природі зустрічається лише у зв'язаному стані та має п'ять модифікацій — білий (отруйний), червоний (полімерний, фіолетовий), чорний (напівпровідник, аналог графіту), металічний (електропровідний) та аморфний. Білий фосфор Р4 має часниковий запах, світиться в темряві та у хімічному відношенні є дуже активним, спалахує на повітрі, тому зберігають його під шаром води. Найчастіше використовується червоний фосфор. Він входить до складу запалювальної маси голівок сірників. Найбільш стабільним і найменш активним є чорний фосфор. Він абсолютно нерозчинний у воді та органічних розчинниках, масний на дотик. Його добувають нагріванням білого фосфору.

Сульфур утворює просту речовину — сірку. Вона має кристалічну та аморфну форми та утворює алотропні модифікації, такі як пластична, ромбічна, моноклинна сірка і метастабільні циклічні форми. Сірка це речовина самородна і є сумішшю модифікацій, які перетворюються за певних умов одна в одну. Так, коли кристалічну сірку розплавити і повільно вилити в холодну воду, вона перетвориться на пластичну. З часом пластична сірка стає моноклинною.

Селен має сіру полімерну, чорну та червону модифікації. Найстійкішою модифікацією є сірий (металічний) селен. Він є напівпровідником, дуже чутливим до світла. Усі модифікації мають молекули Se2, Se4, Se6 та інші. З точки зору хімії вони мають властивості аналогічні із сіркою. Майже усі модифікації селену отруйні. Перетворюються одна в одну. Видозміни селену входять до складу більше 30 сполук, життєво необхідних людині. Без селену не засвоюється в організмі йод, а отже страждає щитоподібна залоза та інші органи-мішені, які потребують її гормонів.

Сірка, графіт і алмаз зустрічаються у літосфері у вільному стані. В Україні поклади сірки є в Івано-Франківській, Львівській і Тернопільській областях, графіт — в Запорізькій та Кіровоградській областях.
Домашнє завдання: вивчити § 15 підручника Попель, Крикля для 11 класу, вправа 112 сторінка 90.




